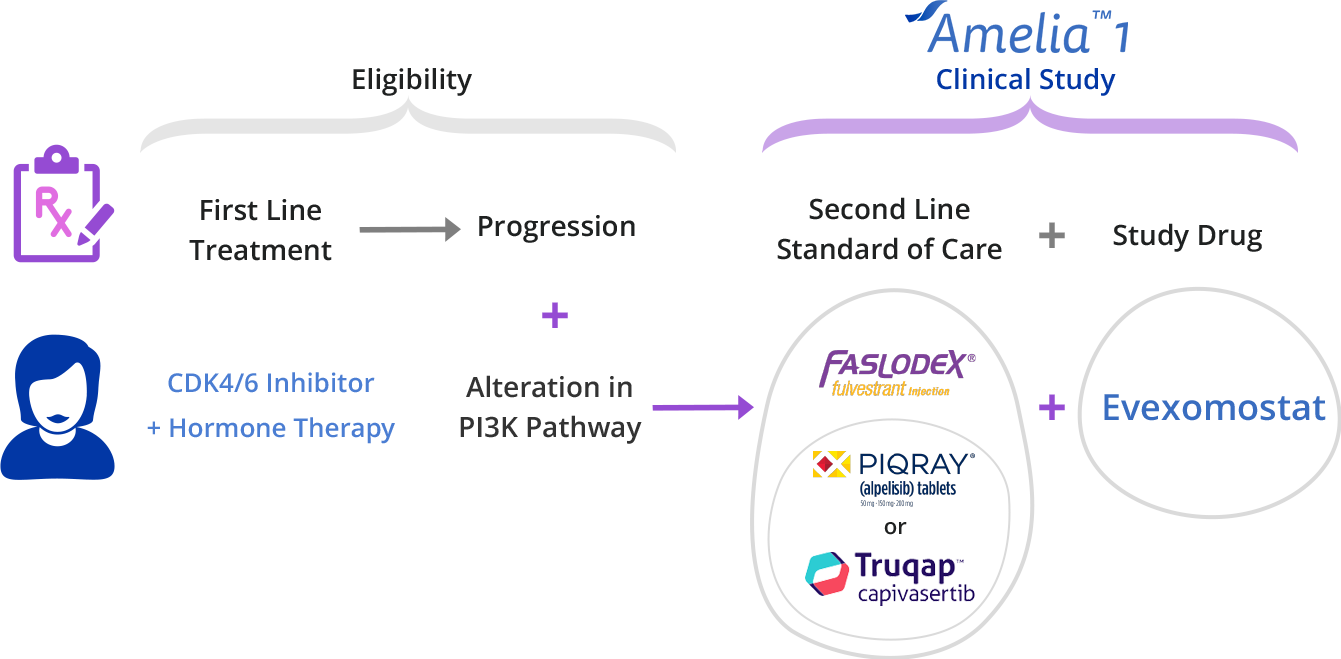
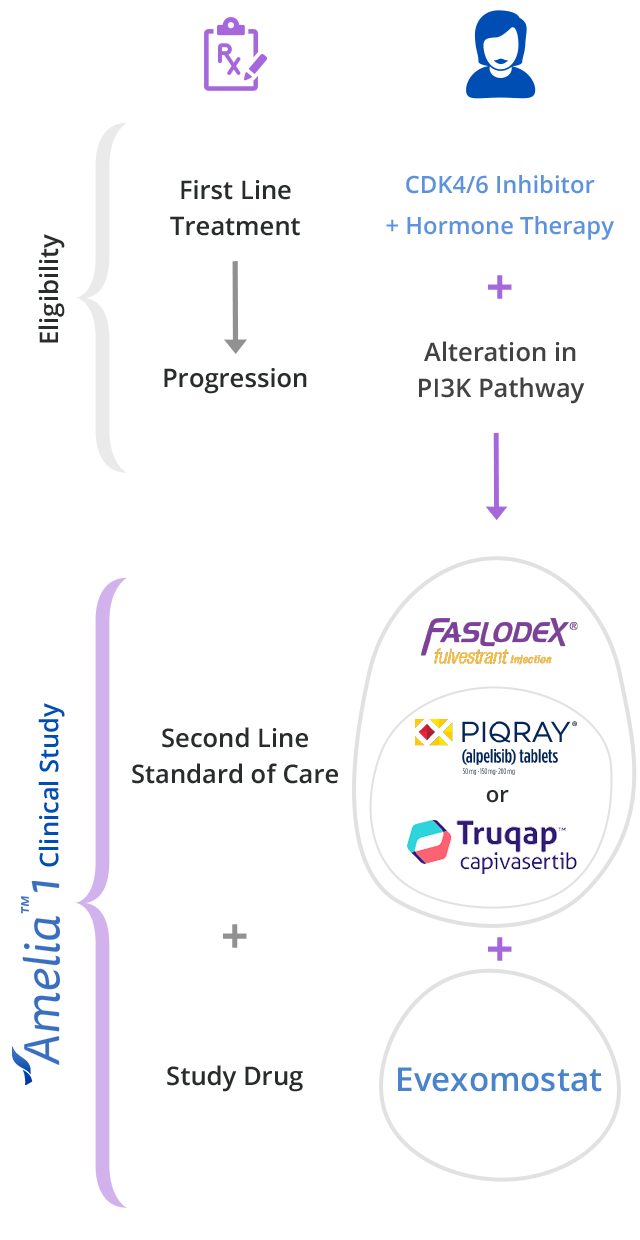
El ensayo clínico Amelia-1 se está inscribiendo ahora para sobrevivientes de cáncer de mama que tienen la mutación del gen PIK3CA.
El ensayo clínico Amelia-1 está probando un nuevo tratamiento experimental contra el cáncer llamado Evexomostat para ver si mejora los resultados clínicos (tanto seguridad como eficacia) cuando se combina con Piqray® y Faslodex®.
¡La esperanza está en camino!
Conceptos básicos del Estudio Amelia-1

Mejorar la resistencia a la insulina inicial podría ayudar a su tratamiento
El Estudio Amelia-1 prueba la hipótesis de que agregar evexomostat (SDX-7320) antes de comenzar a usar Piqray extenderá su tratamiento y, al mismo tiempo, ayudará a reducir los picos de azúcar en la sangre que se observan con frecuencia con Piqray.
● Los picos de azúcar en la sangre son un efecto secundario potencialmente grave al usar Piqray para algunos pacientes.
● Los pacientes con resistencia a la insulina inicial tienen un riesgo elevado de sufrir picos graves de azúcar en sangre.
● Evexomostat es un fármaco experimental que se encuentra en desarrollo y está destinado a pacientes con cáncer de mama, como usted, que tienen la mutación del gen PIK3CA y corren el riesgo de sufrir picos de azúcar en la sangre causados por Piqray.
Justificación clínica del Estudio Amelia-1
✔ En un estudio clínico de Fase 1 en pacientes con cáncer en estadio avanzado, evexomostat mejoró de manera significativa la sensibilidad a la insulina en pacientes con niveles elevados de insulina basal.
✔ Se ha demostrado a nivel clínico que el mecanismo de acción de evexomostat (la inhibición de MetAP2) ayuda a mejorar la sensibilidad a la insulina de los pacientes al tiempo que brinda actividad antitumoral.
✔ En modelos animales de cáncer de mama con la mutación del gen PIK3CA, evexomostat en combinación con Piqray pareció funcionar de manera sinérgica y provocó que los tumores se encogieran.
✔ En animales sanos y normales, evexomostat redujo de manera significativa los picos de glucosa causados por Piqray.
**Todos los estudios clínicos conllevan riesgos. Pídale a su oncólogo que le explique los riesgos antes de considerar unirse al Estudio Amelia-1.


¿Quién puede unirse?
Criterios de inscripción de Amelia-1
Los pacientes que cumplan con los siguientes criterios básicos pueden ser elegibles para participar en el estudio:
1. HR+ (estrógeno o progesterona), Her2-, cáncer de mama metastásico Mutación del gen PIK3CA Previamente tratado con un inhibidor de CDK 4/6 (por ejemplo, Ibrance®) en un entorno de primera línea.
2.
A punto de comenzar el tratamiento de segunda línea para la enfermedad metastásica
⮚ "En riesgo" de hiperglucemia inducida por alpelisib'En riesgo' de hiperglucemia inducida por alpelisib
⮚ "En riesgo" de hiperglucemia inducida por alpelisib
– Nivel de glucosa en ayunas por debajo de 140 mg/dL (lo que significa que no es abiertamente diabético tipo 2) ADEMÁS, tiene:
a) HbA1c entre 5.5 y 6.4, inclusive, -O-
b) Presenta resistencia a la insulina (puntuación HOMA-IR ≥1.8). Esta puntuación es muy fácil de obtener: se calcula con la insulina en ayunas y la glucosa en ayunas; su médico tratante puede ordenar la prueba.
⮚ Hay otros criterios más técnicos que su médico u oncólogo tratante revisará para asegurarse de que usted califica para el estudio.
Si cumple con estos criterios, podría ser un buen candidato para participar en este estudio.
El Estudio Amelia-1 inscribirá inicialmente a unos 20 pacientes para probar la seguridad y eficacia de la combinación de tres fármacos (Evexomostat, Piqray y Faslodex).

Ubicaciones del Estudio clínico

Para unirse, pida a su(s) oncólogo(s) que se comunique(n) con una de nuestras ubicaciones de estudio.
California Ubicaciones:
Loma Linda University Cancer Center
11175 Campus Street, CSP 11005,
Loma Linda, CA 92350
Contacto: Lorena Garcia, CRC
(909) 651-5612
PI: Gayathri Nagaraj, M.D
Hoag Memorial Hospital Presbyterian
One Hoag Drive, Building 39 2nd floor, Newport Beach, CA 92663
Contacto: Jericho Rabago, BSN, RN
(949) 764-6796
PI: Chaitali Nangia, M.D
Sharp Memorial Hospital
7901 Frost Street
San Diego, CA 92123
Contacto: Galen Steinhoff
PI: Kristen Rice, M.D
Florida Ubicaciones:
Miami Cancer Institute
1228 S. Pine Island Rd., Suite 410,
Plantation, FL 33324
Contacto: Elaine Hernandez, Clinical Research Coordinator
PI: Reshma Mahtani, M.D
Miami Cancer Institute
8900 North Kendall Drive,
Miami, FL 33176
Contacto: Elaine Hernandez, Clinical Research Coordinator
PI: Reshma Mahtani, M.D
Illinois Ubicaciones:
Hope and Healing Cancer Services
950 N. York Rd., Suite 201A,
Hinsdale, IL 60521
Contacto: Praneetha Achanta
O: 630 560-0121 x106
F: 630-556-8014
PI: Srilata Gundala, M.D
Michigan Ubicaciones:
Trinity Health/St. Joseph Mercy
5301 East Huron River Drive,
Ann Arbor, MI 48106
Contacto: Trinity Drews, BSN, OCN
tricia.drews@trinity-health.org
PI: Tareq Al Baghdadi
Ohio Ubicaciones:
Cleveland Clinic
9500 Euclid Avenue, CA5,
Cleveland, OH 44195
Contacto: Donicka (Donnie) Wilson
PI: Azka Ali, M.D
Aultman Hospital
2600 Sixth Street Southwest,
Canton, OH 44710
Contacto: Kathleen Collins, RN, BSN
PI: Raza Khan, M.D
Pennsylvania Ubicaciones:
Milton S. Hershey Medical Center
Penn State Cancer Institute
500 University Drive, Suite T2200,
Hershey, PA 17033
Contacto: Cindy Brown
cbrown18@pennstatehealth.psu.edu
PI: Monali Vasekar, M.D
Tennessee Ubicaciones:
Vanderbilt Ingram Cancer Center
2220 Pierce Avenue, PRB 777,
Nashville, TN 37232
Contacto: (800) 811-8484
PI: Brent Rexer, M.D PhD
Vanderbilt Ingram Cancer Center
719 Thompson Lane, Suite 25000,
Nashville, TN 37204
Contacto: (800) 811-8484
PI: Brent Rexer, M.D PhD